
第一作者:贾欠欠
通讯作者:黄理志
通讯单位:皇冠crown (中国)官方网站
图文摘要
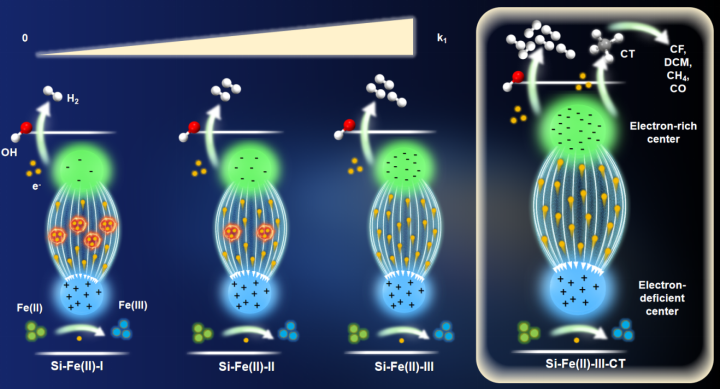
成果简介
近日,武汉大学市政系黄理志团队在Water Research上发表了题为“Reductive dehalogenation in groundwater by Si-Fe(II) co-precipitates enhanced by internal electric field and low vacancy concentrations”的论文。该项工作研究了不同羟基化顺序合成的Si-Fe(II)共沉淀物对有机污染物的还原脱氯机制研究。在有氧条件下Fe(III)和Si之间的相互作用已被广泛研究,但在缺氧和还原条件下Fe(II)和Si之间的相互作用研究很少。在天然地下水环境中,Si和Fe(II)的相互作用是多样的。然而,这种相互作用对Si-Fe(II)共沉淀物的结构和相组成的影响在很大程度上被忽略了。因此,对Si-Fe(II)共沉淀物的结构信息、反应性及其对地下水污染物转化的影响研究较少。这项工作加深了我们对自然地下环境中丰富的Si-Fe(II)相的稳定性、相变、还原反应活性和应用的理解。
引言
铁(Fe)是地壳中含量第四高的元素,几乎存在于所有的水环境中。而硅(Si)占地壳的27.7%,使Si成为仅次于第二丰富的氧元素。因此,硅化合物通常存在于土壤和地下水环境中。溶解硅酸盐也是天然水中的重要成分。Fe和Si之间的相互作用在许多地球化学循环中起着重要作用,尽管Fe(II)和Si之间的相互作用已在有氧条件下进行了广泛研究,但在缺氧和还原条件下Fe(II)和Si的相互作用很少被研究。在天然地下水环境中,Si和Fe(II)的相互作用是多样的。然而,这种相互作用对Si-Fe(II)共沉淀的结构和相组成的影响在很大程度上被忽略了。虽然已知Si-Fe(II)共沉淀相是层状硅酸盐和SiO2,但在原子尺度上尚未清楚地了解Si-Fe(II)共同沉淀的结构信息。因此,很少研究Si-Fe(II)共沉淀的反应性及其对地下水污染物转化的影响。Fe和Si物种的分布强烈取决于溶液pH。羟基化序列可以改变Fe(II)的配位环境,从而导致Fe(II)八面体结构的不同变形程度。这使得Fe(II)的给电子能力被改变。因此,本文研究了羟基化顺序对Si-Fe(II)共沉淀反应性的影响。该研究分析了各种Si-Fe(II)共沉淀的结构与还原脱卤反应之间的关系。这项工作揭示了Si-Fe(II)相互作用对COCs命运的影响,这对于COCs污染的地下水环境的修复具有重要意义。
图文导读
Si-Fe(II)共沉淀物表征

图1. Si-Fe(II)共沉淀物形貌和结构分析. a-f Si-Fe(II)-I, Si-Fe(II)-II 和 Si-Fe(II)-III的SEM-EDS.. g Si-Fe(II)-I, Si-Fe(II)-II and Si-Fe(II)-III的XRD 图. h Si-Fe(II)-I, Si-Fe(II)-II, Si-Fe(II)-III 和 无Si(羟基化亚铁)的红外谱图. i Si-Fe(II)-I, Si-Fe(II)-II 和 Si-Fe(II)-III 的TGA. 实验条件: [Fe(II)]0=20 mM, [Si]0=5 mM, pH=7.
我们通过改变羟基化顺序合成了不同类型的Si-Fe(II)共沉淀物。Si-Fe(II)-III中Si的表面超结构中固有的表面态带更多地位于Si-Fe(II)共沉淀的表面。由于Si的表面超结构的存在,在硅表面形成二维带。带中的电子沿着三维带中的表面态载流子移动。吸附的铁原子还可以将载流子注入表面态带。因此,电导率提高,导致Si-Fe(II)-III的高还原活性。Si-Fe(II)-I和Si-Fe(II)-II为白色沉淀,而Si-Fe(II)-III的颜色在老化20分钟后从白色变为浅灰绿色。Si-Fe(II)-I主要由针铁矿、铁氢化物、氯化铁、FeSiO3、FeO(OH)和结晶不良的SiO2组成。Si-Fe(II)-III的主要成分是FeSiO3和SiO2,其结晶度略高于Si-Fe(II)-II。FTIR和TGA表明,不同羟基化顺序得到的Si-Fe(II)共沉淀物中Fe(II)的配位环境是显著不同的。
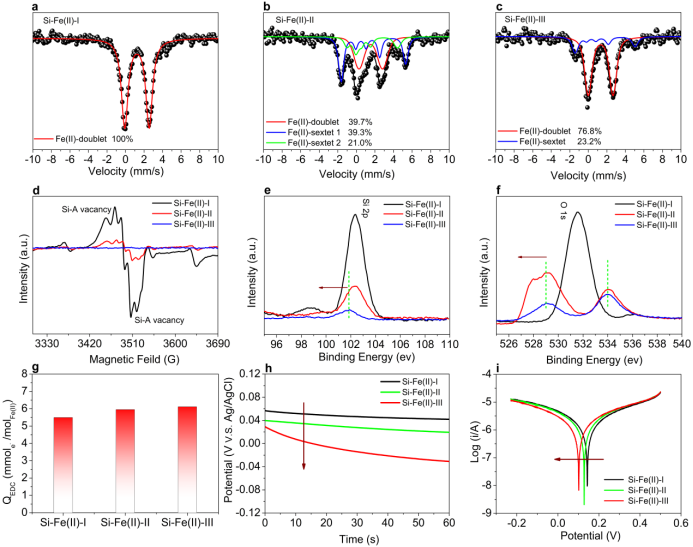
图2. Si-Fe(II)共沉淀物的局域结构、化学态和给电子能力。a-c Si-Fe(II)-I, Si-Fe(II)-II 和Si-Fe(II)-III 在 13 K时的穆斯堡尔谱图. d Si-Fe(II)-I, Si-Fe(II)-II 和Si-Fe(II)-III 在室温时EPR 谱图. e Si-Fe(II)-I, Si-Fe(II)-II 和 Si-Fe(II)-III 中Si 2p 的XPS谱图. f Si-Fe(II)-I, Si-Fe(II)-II 和 Si-Fe(II)-III 中O 1s 的XPS谱图. g ABTS作为介体时的Si-Fe(II)-I、Si-Fe(II)-II和Si-Fe(II)-III的QEDC。 Si-Fe(II)-I、Si-Fe(II)-II和Si-Fe(II)-III在无氧的0.5M Na2SO4 溶液中的h 开路电压 和 i Tafel 曲线. 实验条件: [Fe(II)]0=20 mM, [Si]0=5 mM, pH=7.
在13K下获得了不同羟化顺序的Si-Fe(II)共沉淀物的穆斯堡尔谱(图2a-c)。穆谱结果直接表明在不同羟化顺序的Si-Fe(II)共沉淀物中,Fe(II)周围的局部配位环境明显不同。在Si-Fe(II)-I和Si-Fe(II)-II中发现了与Si-A中心相关的空位,且后者的空位强度较弱。相比之下,Si-Fe(II)-III中没有观察到Si-A空位(图2d)。值得注意的是,与Si-Fe(II)-I和Si-Fe(II)-II相比,Si-Fe(II)-III的O1s和Si 2p XPS峰向较低的结合能移动(图2e-f),这表明在Si-Fe(II)-III中,电子从Fe(II)部分转移到O和Si。这一现象与EPR数据(Si-Fe(II)-III中的Fe(II)具有很强的给电子能力)是一致的。在强氧化剂(ABTS)存在下,Fe(II)在三种不同类型的Si-Fe(II)共沉淀物中的给电子能力是相同的,结构差异对还原反应活性的影响可以忽略。Si-Fe(II)-III的开路电位最低,说明在所研究的Si-Fe(II)共沉淀物中,Si-Fe(II)-III最不稳定。在三种样品,Si-Fe(II)-III的腐蚀电流最高(1.439×10−6A),说明Si-Fe(II)-III具有最高的还原活性。
Si-Fe(II)共沉淀物对CT的降解

图3. 环境相关条件下Si-Fe(II)共沉淀物还原CT的研究. a 不同Si-Fe(II)共沉淀物对CT还原的产物分布和反应速率, b Eh随时间的变化, c 不同Si-Fe(II)共沉淀物对CT还原的电子利用率和选择性, dSi投加量对脱氯产物分布和CT降解率的影响, e Si投加量对Si-Fe(II)-III共沉淀物Zeta电位的影响([Si]0=0-10 mM), f 离子影响([ions]=1 mM (HA=1 mg/L)), g Si形式影响, h地下水对脱氯产物分布和CT降解率的影响. 实验条件: [Fe(II)]0=20 mM,[CT]0=20 μM, [Si]0=5 mM, 反应时间 = 90 min, pH=7.
Si-Fe(II)-III在90min内将CT还原为CF、DCM和CH4,但Si-Fe(II)-I和Si-Fe(II)-II体系对CT的还原反应活性很弱(图3a)。Si-Fe(II)-I、Si-Fe(II)-II和Si-Fe(II)-III的Eh值差异不显著,说明它们的反应活性差异并不主要是由于Eh值的不同(图3b)。在三种类型的Si-Fe(II)共沉淀物中,Si-Fe(II)-III的利用率(UR,1.47±0.02%)和电子选择性(ES,85.1%)是最高的(图3c)。随着−用量从0.084增加到10 mM,Si-Fe(II)-III还原CT的速率变慢,伪一级速率常数(k1)从0.084 min−1下降到0.00672 min−1 (图3d)。随着Si用量的增加,Si-Fe(II)-III共沉淀物的Zeta电位逐渐降低,且均为正值(图3e)。这表明,随着Si加入量的增加,Si-Fe(II)-III共沉淀物的分散性变差。带正电的Si-Fe(II)表面([FeII-O-Si]+)具有稳定卡宾阴离子的作用。不管这些表面结合中间体的性质如何,这一系列连续的加氢还原最终将形成CH4。无机阴离子SO42−, CO32−, PO43−, NO3−的存在使CT还原速率常数(k1)从0.04419 min−1分别降至0.03013 min−1、0.02331 min−1、0.02145 min−1和0.01896 min−1 (图3f)。而HA、Ca2+、Mg2+和Fe3+的存在则是促进Si-Fe(II)-III共沉淀物对CT的还原脱氯。在Si-Fe(II)共沉淀物/CT体系中,Si的形态对还原反应活性和产物分布有重要影响(图3g)。与超纯水相比,真实地下水中Si-Fe(II)共沉淀物对CT的还原作用受到抑制(图3h)。
机理分析
结构变形、内电场与空位

图4. 内电场 a Si-Fe(II)-I, b Si-Fe(II)-III, c Si-Fe(II)-III, d Si-Fe(II)-III 共沉淀物 + CT, e Si-Fe(II)共沉淀物的简化图.
在Si-Fe(II)共沉淀物中,Si-Fe(II)-III中Fe(II)双重态的ΔEQ值较大。对于六配位Fe(II)物种,八面体结构的小范围扭曲导致了较大的四极分裂(ΔEQ)值。因此,Si-Fe(II)-III的Fe(II)八面体的结构变形比Si-Fe(II)-I的小,这可能与Si-Fe(II)-III具有较高的还原活性有关。另一方面,Si-Fe(II)-II和Si-Fe(II)-III分别含有两个和一个Fe(II)六重态。在超精细相互作用中,Fe(II)六重态的中心位移(CS)值越高,Fe(II)的s电子密度就越低。在Si-Fe(II)共沉淀物中,Si-Fe(II)-III的CS值最低,为1.087 mm/s。因此,Si-Fe(II)-III中的Fe(II)可能向O原子提供更多的电子。Fe(II)八面体的结构扭曲可能是由Jahn-Teller效应和空位引起的。结果表明,空位浓度按Si-Fe(II)-I>Si-Fe(II)-II>Si-Fe(II)-III的顺序递减,这与结构扭曲程度的大小顺序相同。我们的结果与前人的研究结果之间的矛盾表明,决定Si-Fe(II)共沉淀物结构扭曲的是Jahn-Teller效应,而不是空位。Si-Fe(II)-III的低结构扭曲程度可能导致其较高的还原反应活性。
Si-Fe(II)共沉淀物表面Fe物种在724.8-723.4 eV和709.9-711.3 eV的结合能可分别分配给Fe(II)的2p3/2和2p1/2(图S3a)。这一结合能高于FeO中Fe(II)的结合能(722.8和709.8 eV),证实了Si-Fe(II)共沉淀物中Fe位附近的缺电子性质。因此,在Si-Fe(II)共沉淀结构中,较高的电子密度集中在与晶格Si相邻的晶格O2−中。较低的电子密度分布在Fe位置附近,形成无数的内电场。富电子的O中心充当阴极,晶格Fe充当阳极。内电场的方向是从富电子中心到贫电子中心(图4a-d)。缺电子的Si-A空位容易在Si-Fe(II)结构中提取/捕获电子,抑制了可能的电子从Fe(II)到与Si原子相邻的富电子晶格O2−的转移。因此,电子密度最高的区域离Si更近。四面体Si周围电荷密度的增加自发地增加了其邻近O原子的电子密度。这导致连接到O原子的H原子首先得到电子(图4e),连接到四面体Si的羟基被还原为H2。因此,Si-Fe(II)-III的最高反应活性源于其独特的电子结构(图2)。
表面羟基和吸附CT增强内电场

图5. 表面羟基和吸附态CT强化内电场. a不同Si-Fe(II)共沉淀物的H2释放 ([Fe(II)]0=20 mM, [Si]0=5 mM, 反应时间 = 90 min, pH=7). b CT存在时不同Si-Fe(II)共沉淀物的H2释放([Fe(II)]0=20 mM, [CT]0=20 μM, [Si]0=5 mM, 反应时间= 90 min, pH=7). c Si-Fe(II)-III 共沉淀物在不同pH下的FTIR 光谱. d 不同pH条件下Si-Fe(II)共沉淀物的H2释放([Fe(II)]0=20 mM, [Si]0=5 mM, 反应时间 = 90 min, pH=5, 7, 8, 10 and 13). e CT存在时,不同pH条件下Si-Fe(II)共沉淀物的H2释放([Fe(II)]0=20 mM, [CT]0=20 μM, [Si]0=5 mM, 反应时间 = 90 min, pH=5, 7, 8, 10 and 13). f不同pH值下Si-Fe(II)-III还原脱氯反应的产物分布和反应速率. g 不同pH值下Si-Fe(II)-III的XRD. h 不同pH值下Si-Fe(II)-III的zeta电位. i不同Si-Fe(II)共沉淀物的电子平衡. 实验条件: [Fe(II)]0=20 mM, [Si]0=5 mM, 反应时间= 90 min, pH=5, 7, 8, 10, 13.
Si-Fe(II)共沉淀物本身可以通过表面羟基的氧化产生氢气(图4a-c和图5a)。随着时间的延长,H2的释放浓度逐渐增加。此外,与Si-Fe(II)-I和Si-Fe(II)-II相比,Si-Fe(II)-III在90min时释放的H2相对较高。这是因为Si-Fe(II)-III不仅表面羟基含量最高(图1i),而且还原强度最强(图4c)。CT的加入促进了体系中氢气的产生(图5b)。CT的氯是一个亲电基团,这导致富电子区域的电子密度增加,表面羟基被氧化。此外,随着pH的升高,Si-Fe(II)-III释放的H2逐渐增加(图5d)。在相同的pH条件下,CT的存在促进了H2的产生(图5e)。这一现象进一步证明了羟基浓度的增加和CT的存在可以增强内电场。Si-Fe(II)-III共沉淀物在pH值为5时完全溶解,导致还原反应活性降低(图5f)。在酸性条件下,Si-Fe(II)不与表面羟基配位,不形成内部电场。另一方面,随着pH的升高,Si-Fe(II)-Ⅲ对CT的还原速率逐渐增加(图5f和S18),并在pH为13(k1=0.88738 min−1)时达到最大。随着pH值的升高,Si-Fe(II)-III主要为FeSiO3,结晶度增加,少量结晶不良的SiO2(图5g)。这一现象证实了FeSiO3在Si-Fe(II)-III还原CT过程中的重要作用。随着pH的升高,Si-Fe(II)-III的Zeta电位逐渐由正向负转变(图5h)。此外,Fe(II)(e0)给出的电子数是CT还原(ep)和氢释放反应(ei)消耗的电子数之和(图5i)。这进一步揭示了表面羟基和CT消耗相同的Fe(II)电子源进行进一步的转化。
小结
这项研究证明了在可能的自然地下环境中形成的Si-Fe(II)共沉淀物的结构和反应活性的多样性。不同的硅羟化顺序对氧化还原活性Fe(II)中心的配位环境有显著影响。不同的合成方法制备的Si-Fe(II)共沉淀物的物相组成有显著差异。Si-Fe(II)共沉淀物由无数的内电场组成,羟基的转化和四氯化碳(CT)的转化都消耗了电子。然而,羟基和CT的共存由于电负性增加了富电子区域的电子密度,增强了它们的接受电子的能力。与其他化学成分相同的Si-Fe(II)共沉淀物相比,Si-Fe(II)-III的结构扭曲程度低,空位浓度低,表面羟基和吸附的CT分子增强了内电场,使其具有较高的还原反应活性。
本项目得到了国家自然科学基金委、中央高校基本科研业务费专项资金项目和武汉大学人才引进启动经费。
通讯作者简介

黄理志:武汉大学研究员、博导,湖北省高层次人才,中国水协青年委委员,国际水协会员,主持多项国家级科研项目,发表论文50余篇,以第一/通讯作者在Environmental Science & Technology、Water Research等期刊发表SCI论文41篇(其中35篇中科院一区、33篇影响因子>10、1篇ESI高被引);授权发明专利4项,技术应用2项,成果转化1项。指导学生科研竞赛获国家级奖励7项,省部级奖励6项。
课题组网站:https://www.x-mol.com/groups/lizhihuang
第一作者:贾欠欠,女,博士研究生,现就读于皇冠crown (中国)官方网站。
文章链接:https://doi.org/10.1016/j.watres.2022.119386